メリット
精確。モジュール型。スケーラブル。
製品スポットライト
多彩な画像再生ソリューション
当社の画像再生技術の力により、手術室や診療所において、最適化された視覚化オプションにアクセスできるようになります。さまざまな構成オプションによって、ニーズと予算に最適な画像チェーンを構築できます。
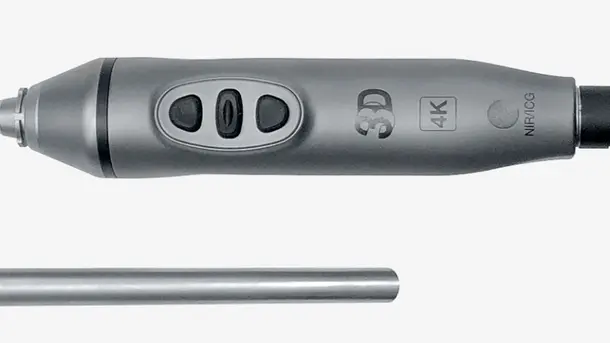
IMAGE1 S™ Rubina®
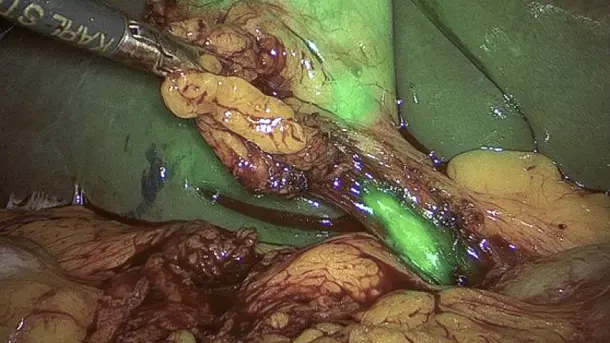
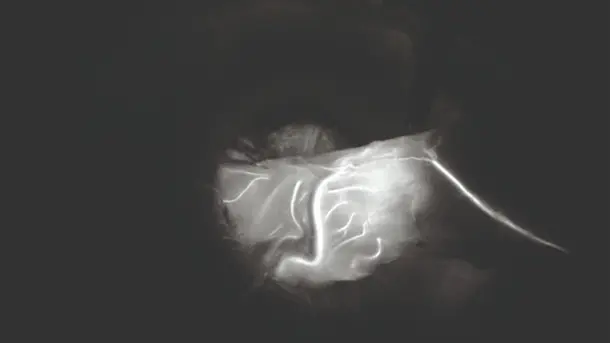
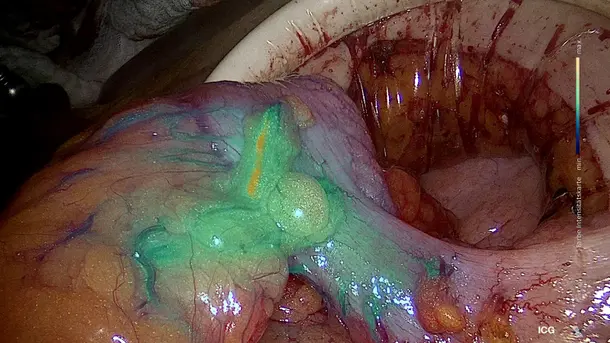
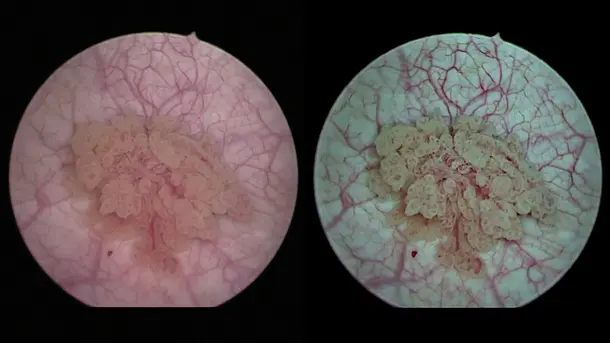
3D と 4K のテクノロジーを NIR蛍光イメージングと組み合わせることにより高品質の情報が得られるようになり、検出と手術の精度が向上します。NIRによって、灌流の評価やセンチネルリンパ節の検出といった診断の可能性が広がります。
ビジュアリゼーションモード
さまざまな視覚化モードを、ぜひご覧ください。構造がさらにはっきりと識別できるようになります。
IMAGE1 S™ Rubina® 製品グループ

IMAGE 1 S™
当社では患者を最適に視覚化できる適切なソリューションを提供し、皆様が可能な限り最高の治療成果を達成できることを目指しています。皆様のニーズに個別に適合できるモジュール型の持続可能なソリューションの力で、幅広い視覚化オプションを実現しています。
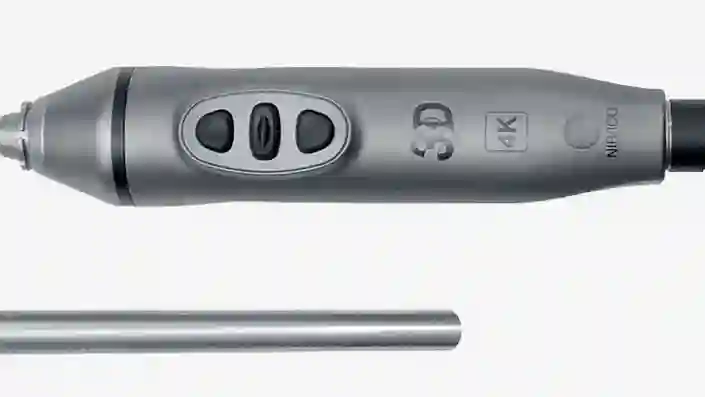
TIPCAM®1 Rubina®
このオールインワンタイプのビデオ内視鏡では、4K、3D、NIR の 3 つの高度なイメージング技術が 1 つの製品に統合され、視覚化の向上と最適な奥行き認識を実現しています。

Power LED Rubina®
レーザーを使用しないこの光源装置は、白色光とNIRアプリケーションでの使用向けに開発されており、効率性と耐久性に特色があります。
NIRイメージングソリューションをパーフェクトなものにしましょう
お客様のニーズに合わせたシステムに、これらのコンポーネントを組み合わせてください。
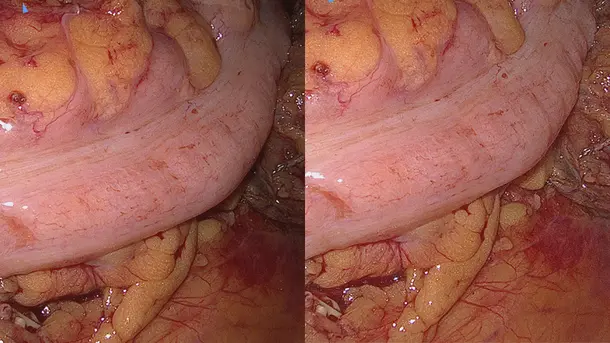
IMAGE1 S™ Rubina® 使用範囲
IMAGE1 S™ Rubina® システムのおかげで、蛍光ガイド手術において大きな一歩を踏み出すことができました。まさに真っ暗闇の中だったのが、4K/3Dの光に飛び込んで、患者さんの治療が、さらに良いものとなりました。
IMAGE1 S™ 4U
内視鏡の画質が次の段階に進化した 4K の導入により、手術中に細部を確認して識別できるようになりました。これにより画像再生の最適化に対する弊社のたゆまぬ取り組みが、さらに進化しました。
ビジュアリゼーションモード
さまざまな視覚化モードを、ぜひご覧ください。構造がさらにはっきりと識別できるようになります。
IMAGE1 S™ 4U 製品グループ
4K イメージングソリューションをパーフェクトなものにしましょう
お客様のニーズに合わせたシステムに、これらのコンポーネントを組み合わせてください。
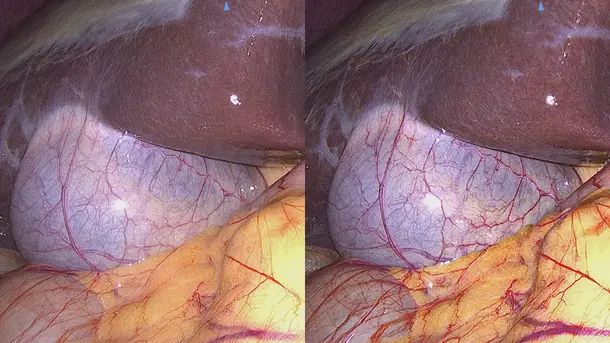
IMAGE1 S™ 4U 使用範囲
IMAGE1 S™ テクノロジーが当院で導入された時のことなのですが、それまでに見たことのないものが突然見えるようになりました。よく見えるようになれば、それだけよい治療ができますからね。
IMAGE1 S™ Saphira™
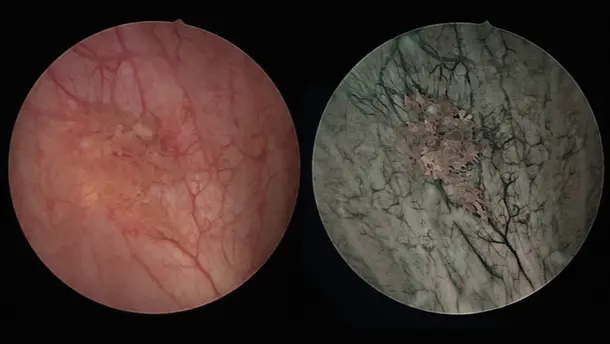
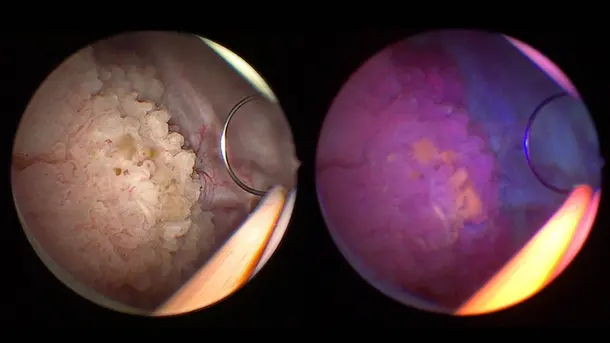
ブルーライトイメージング (BLI) 、PDD とも呼ばれていますが、これは白色光診断では検出できない、ないしは検出が困難なことが多い初期段階の悪性腫瘍を視覚化できるようになります。
ビジュアリゼーションモード
さまざまな視覚化モードを、ぜひご覧ください。構造がさらにはっきりと識別できるようになります。
IMAGE1 S™ Saphira™ 製品グループ

IMAGE 1 S™
当社では患者を最適に視覚化できる適切なソリューションを提供し、皆様が可能な限り最高の治療成果を達成できることを目指しています。皆様のニーズに個別に適合できるモジュール型の持続可能なソリューションの力で、幅広い視覚化オプションを実現しています。

IMAGE1 S™ HX-P FI カメラヘッド
このペンデュラムタイプのカメラヘッドは、ブルーライトのイメージングと白色光アプリケーション向けに開発されたもので、その設計と軽量化ゆえに、人間工学に基づいた作業を実現しております。

POWER LED Saphira™
レーザーを使用しないこの光源装置は、白色光とブルーライトイメージングでの使用向けに開発されでおり、効率性と耐久性に特色があります。
ブルーライト・イメージング ソリューションをパーフェクトなものにしましょう
お客様のニーズに合わせたシステムに、これらのコンポーネントを組み合わせてください。
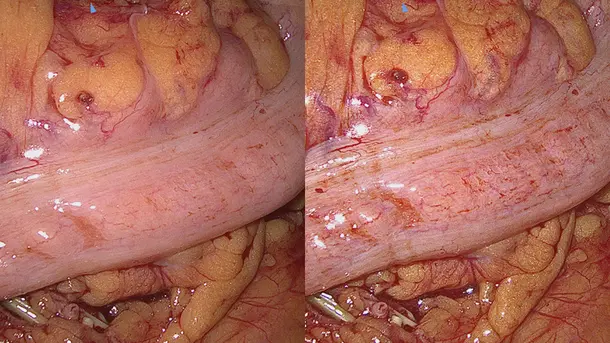
IMAGE1 S™ Saphira™ 使用範囲
ここ数か月の間、新型の Saphira™ 光源装置を使う機会があったのですが、処置の品質が大幅に向上しました。
TELE PACK+
互換性オプションが数多くあるため、診断と簡単な処置のためのこのコンパクトなプラットフォームは、診療所、日帰り手術、緊急治療室、集中治療室、外来診療所での使用に最適です。.
TELE PACK+ 製品グループ
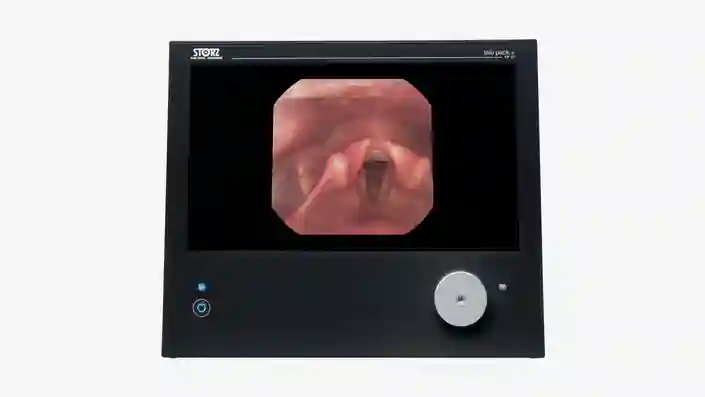
TELE PACK+
モニター、LED 光源装置、カメラコントロールユニット、および統合型ネットワーク機能を備えた記録を組み合わせたコンパクトでポータブルな本製品のメリットを体験してください。

X ラインと C ライン
TELE PACK+ にはX ラインと C ライン接続が備わっており、数多くの硬性鏡、軟性内視鏡、ディスポーザブル内視鏡との互換性があるため、ほぼすべての医療分野での使用に適しています。
コンパクトなフル HD イメージングソリューションをパーフェクトなものにしましょう
お客様のニーズに合わせたシステムに、これらのコンポーネントを組み合わせてください。
TELE PACK+ 使用範囲
新しい TELE PACK+ システムは画質が素晴らしく、困難な症例でもあっても効果的な診断ができるので、とても気に入っています。
TELECAM C3
カメラコントロールユニットは、診療所や手術環境での診断や簡単な処置に適しています。互換性のある内視鏡の数々での使用を想定した設計となっているため、ほぼすべての診療科で使用できます。
TELECAM C3 製品グループ

TELECAM C3
当社のお買い得でコンパクトなカメラコントロールユニットは、内視鏡による簡単な処置向けの設計で、2 つのカメラポートが備わっているため、様々な内視鏡との互換性が保証されます。

X ラインと C ライン
TELE PACK C3 にはX ラインと C ライン 接続が備わっており、数多くの硬性内視鏡、軟性内視鏡、ディスポーザブル内視鏡との互換性があるため、ほぼすべての医療分野での使用に適しています。

POWER LED 175
レーザーを使用しないこの光源装置は、小腔での白色光での使用向けに開発されでおり、効率性と耐久性に特色があります。
フル HD イメージングソリューションをパーフェクトなものにしましょう
お客様のニーズに合わせたシステムに、これらのコンポーネントを組み合わせてください。
TELECAM C3 使用範囲
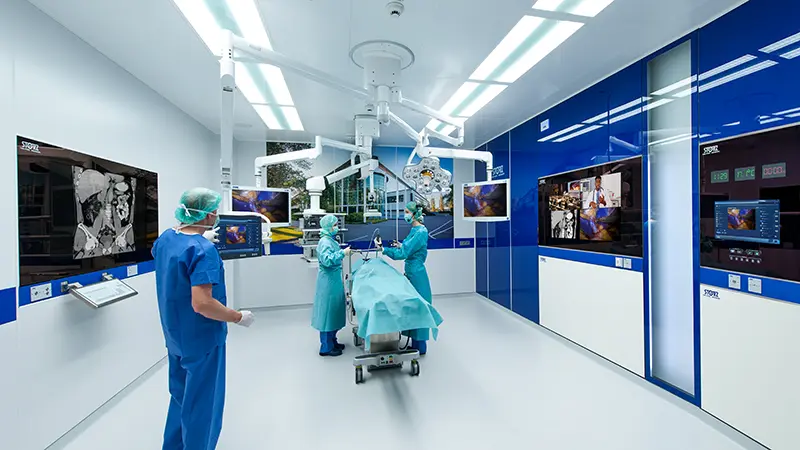
皆さまのニーズに合わせた最先端の手術スペースを構築
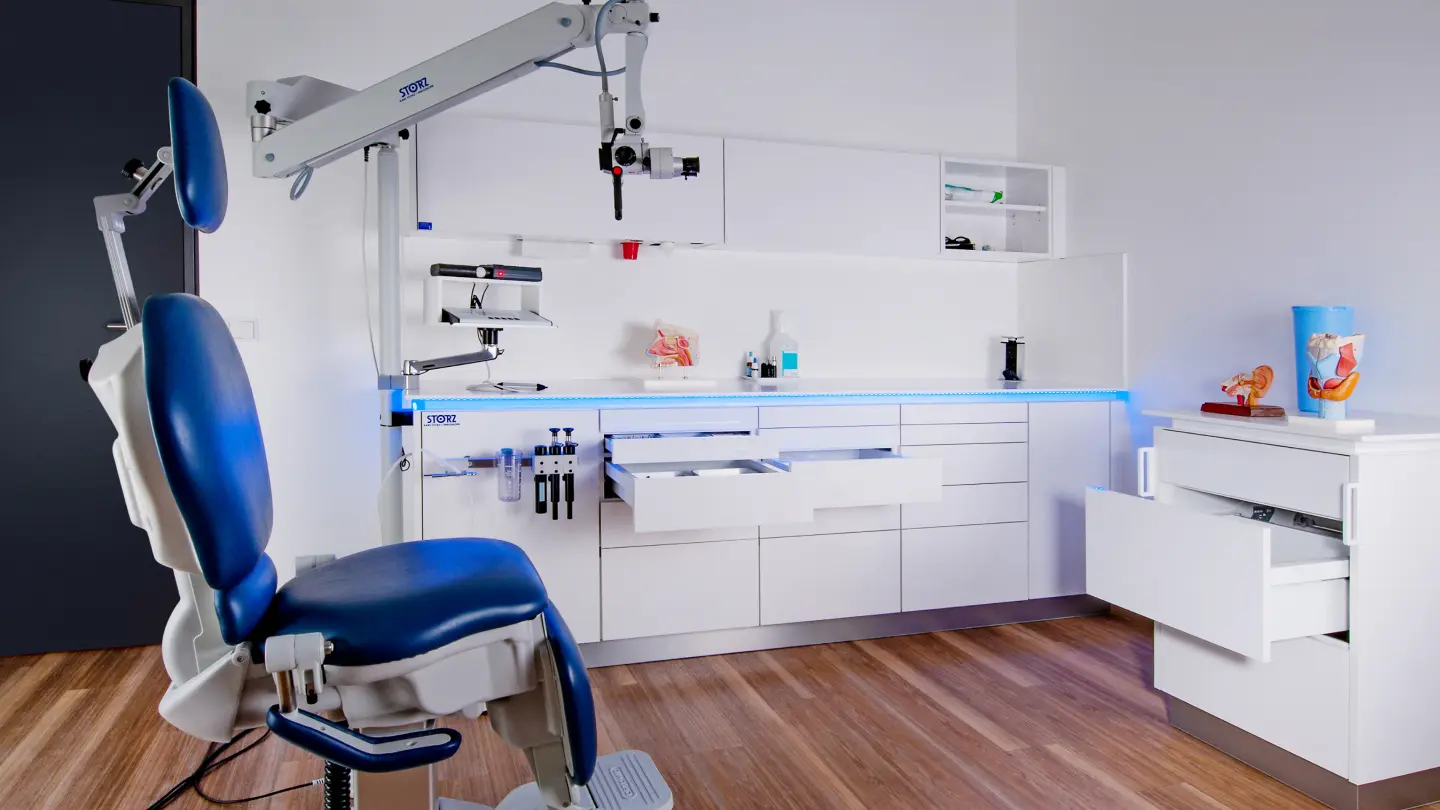
次世代のトレーニング
トレーニングコース、ワークショップ、会議を通じて、世界中の医師やアシスタントの皆さまをサポートしています。手術の技術や関連する器具や装置が複雑になればなるほど、的を絞った教育、継続教育、専門能力開発の重要性が増大しています。
連絡先 担当のスペシャリストにご連絡下さい。
私たちは、すべてのプロセスを通じてお客様をご案内し、お客様の手術のニーズに合った適切なソリューションをカスタマイズするお手伝いをいたします。